
~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH
12-02-2025 - Chemistry Basics - Energy Levels [EN]-[IT]
With this post I would like to give a brief instruction about the topic mentioned in the subject
(code notes: X_95)
Energy Levels
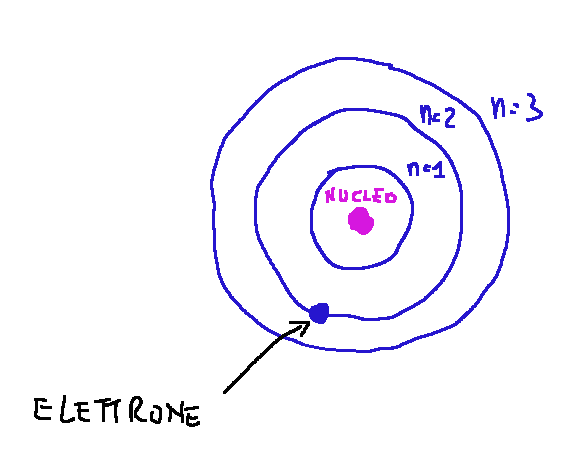
The energy levels of electrons within an atom are fundamental concepts in both chemistry and physics. These levels determine the behavior and chemical properties of atoms
In a quantum atom, electrons are negatively charged particles that orbit around the atom in a certain energy level, on an orbital of a particular shape and orientation.
In the drawing above I try to show that electrons in an atom occupy orbitals that are distributed in discrete energy levels. Each energy level is associated with a principal quantum number (n)
Level transition formula
The frequency of light emitted when an electron in the hydrogen atom transitions from a higher energy level 𝑛2 to a lower energy level 𝑛1 is given by the formula:
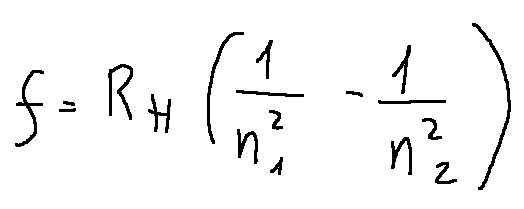
Where:
RH = 3.29×10^15 Hz is the Rydberg constant
n1 =1 (final level)
n2 =2 (initial level).
The Rydberg constant
The Rydberg constant (RH) is a fundamental physical constant that appears in the formulas describing the spectrum of the hydrogen atom. It is used to calculate the frequencies of electronic transitions between energy levels in the hydrogen atom.
In the Bohr atomic model of the hydrogen atom, when an electron passes from the energy level with quantum number n2 to the energy level with quantum number n1 (n2>n1), light of frequency f equal to the formula expressed above occurs.
According to Bohr
According to Bohr, each stationary orbit must satisfy the following relation:
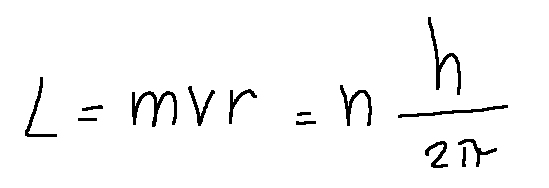
Where n (n=1,2,3,...) is a positive integer. In particular, for n=1, the angular momentum is equal to ℎ/2𝜋. The number n is called the principal quantum number.
NOTE:
In the Bohr atomic model of the hydrogen atom, the energy Etot of the electron in orbit (circular of radius r) around the nucleus is related to the principal quantum number by the relation in which Etot is inversely proportional to n^2.
In fact In the Bohr atomic model for the hydrogen atom, the total energy of the electron in a quantum level 𝑛 is given by the following formula:
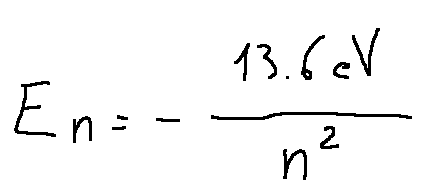
NOTE2:
Also according to the Bohr atomic model of the hydrogen atom, the radius r of the electron orbit is related to the principal quantum number n according to the relation in which r is proportional to n2.
In fact, in the Bohr atomic model for the hydrogen atom, the radius of the electron orbit is given by the following formula:
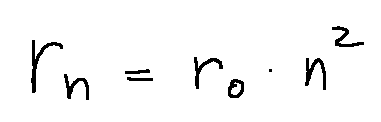
Conclusions
Electrons in atoms occupy well-defined energy levels, called orbitals, characterized by the principal quantum number 𝑛. The formation of chemical bonds is explained by the chemical behavior of atoms which is determined by the energy levels of the electrons
Question
Did you know that Bohr (a Danish physicist) was the first to theorize the energy levels of electrons?

[ITALIAN]
12-02-2025 - Basi di chimica - Livelli energetici [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_95)
Livelli energetici

I livelli energetici degli elettroni all'interno di un atomo sono concetti fondamentali sia in chimica che in fisica. Questi livelli determinano il comportamento e le proprietà chimiche degli atomi
In un atomo quantistico gli elettroni sono particelle di carica negativa che orbitano intorno all'atomo in un determinato livello energetico, su un orbitale di una particolare forma e orientamento.
Nel disegno qui sopra mostrato cerco di mostrare che gli elettroni in un atomo occupano orbitali che sono distribuiti in livelli energetici discreti. Ogni livello energetico è associato a un numero quantico principale (n)
Formula del passaggio di un livello
La frequenza della luce emessa quando un elettrone nell'atomo di idrogeno passa da un livello energetico superiore 𝑛2 a un livello inferiore 𝑛1 è data dalla formula:
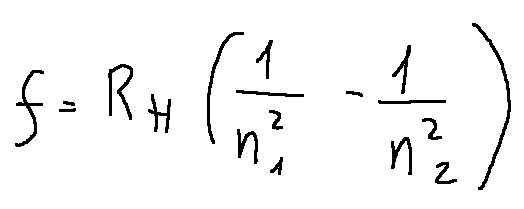
Dove:
RH = 3.29×10^15 Hz è la costante di Rydberg
n1 =1 (livello finale)
n2 =2 (livello iniziale).
La costante di Rydberg
La costante di Rydberg (RH) è una costante fisica fondamentale che appare nelle formule che descrivono lo spettro dell'atomo di idrogeno. È utilizzata per calcolare le frequenze delle transizioni elettroniche tra livelli energetici nell'atomo di idrogeno.
Nel modello atomico di Bohr dell'atomo di idrogeno quando un elettrone passa dal livello energetico con numero quantico n2 al livello energetico con numero quantico n1 (n2>n1) avviene un emissione di luce di frequenza f pari appunto alla formula espressa qui sopra.
Secondo Bohr
Secondo Bohr, ciascuna orbita stazionaria deve soddisfare alla seguente relazione:
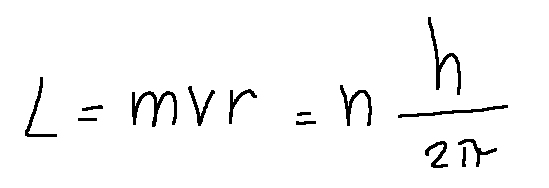
Dove n (n=1,2,3,...) è un numero intero positivo. In particolare, per n=1, il momento angolare è pari a ℎ/2𝜋. Il numero n si chiama numero quantico principale.
NOTA:
Nel modello atomico di Bohr dell'atomo di idrogeno l'energia Etot dell'elettrone in orbita (circolare di raggio r) intorno al nucleo è legata al numero quantico principale tramite la relazione in cui Etot è inversamente proporzionale a n^2.
Infatti Nel modello atomico di Bohr per l'atomo di idrogeno, l'energia totale dell'elettrone in un livello quantico 𝑛 è data dalla seguente formula:
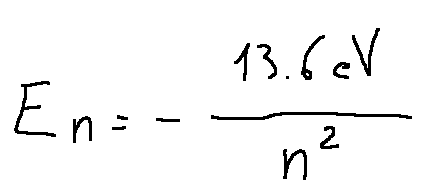
NOTA2:
Sempre secondo il modello atomico di Bohr dell'atomo di idrogeno il raggio r dell'orbita dell'elettrone è legato al numero quantico principale n secondo la relazione in cui r è proporzionale a n2.
Infatti nel modello atomico di Bohr per l'atomo di idrogeno, il raggio dell'orbita elettronica è dato dalla seguente formula:
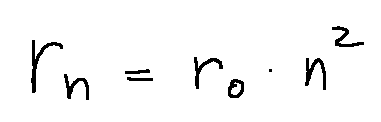
Conclusioni
Gli elettroni negli atomi occupano livelli energetici ben definiti, detti orbitali, caratterizzati dal numero quantico principale 𝑛. La formazione dei legami chimici è spiegata dal comportamento chimico degli atomi che è determinato dai livelli energetici degli elettroni
Domanda
Lo sapevate che fu Bohr (un fisico danese) il primo a teorizzare i livelli energetici degli elettroni?
THE END


