Energía Atómica: El Átomo parte 1
¡Hola, hola, Hivernautas! En esta oportunidad abordaré una saga muy interesante y espero que sea de su total agrado, me refiero nada más y nada menos a la Energía Atómica, pero para entrar a tema es primordial conocer un elemento químico muy importante, El Átomo. Los átomos son las partículas subatómicas más pequeñas de la materia. Contiene una estructura compleja que integra neutrones, protones y electrones. Los protones se encuentran en el núcleo y determinan el rasgo químico del átomo, mientras que los electrones rodean el núcleo. ¿Y si estudiamos como ha sido el proceso histórico del descubrimiento del Átomo?.
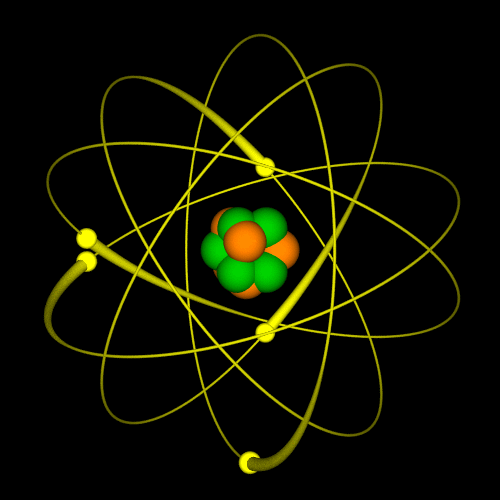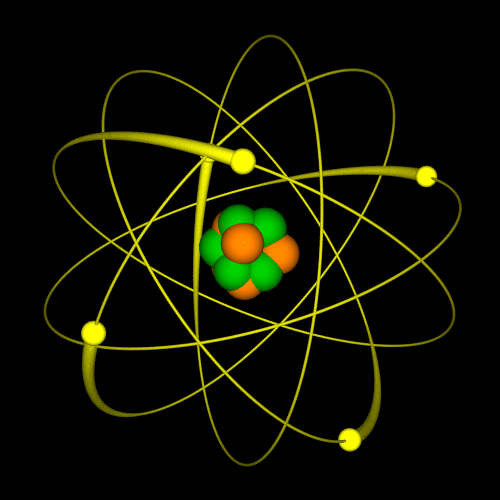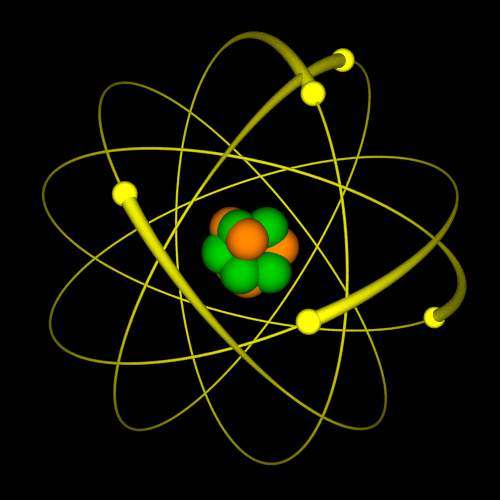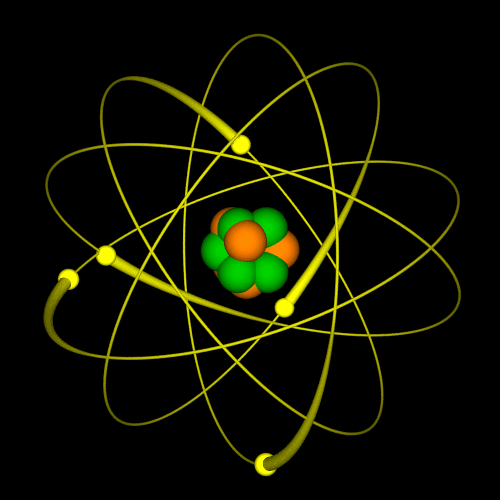
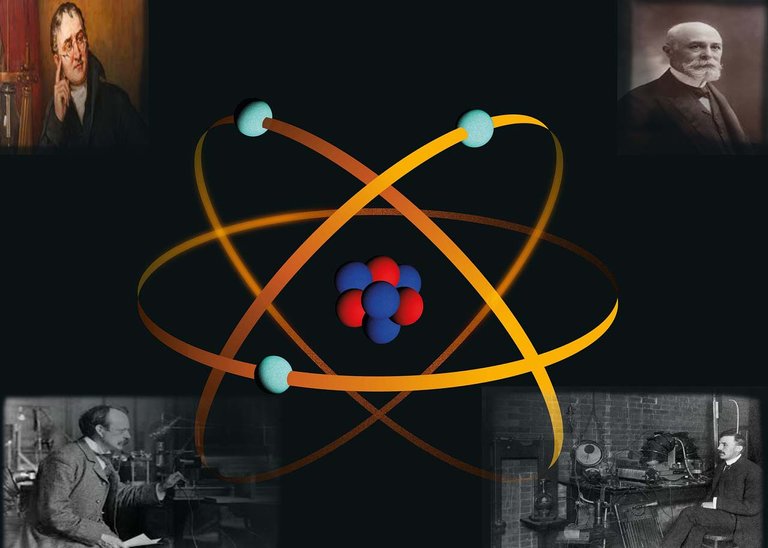
Representación de un Átomo. Créditos: Imagen libre commons.wikimedia.org
Aunque el descubrimiento y aplicación de la energía atómica son cosas de nuestro tiempo, algunos sabios de la antigüedad ya habían vislumbrado determinados aspectos de la constitución de la materia.
Hacia el año 450 antes de Cristo, Empédocles postuló el principio de conservación de la materia, que Lavoisier comprobaría experimentalmente 21 siglos más tarde: la materia no se crea ni se destruye, pero puede transformarse. Zenón y Demócrito llegaron a proclamar la existencia de átomos como las partículas más pequeñas en las que podía dividirse la materia. Esta unidad fundamental de la materia era, para ellos, un corpúsculo increíblemente pequeño, dotado de movimiento y que precisaba cierto espacio para moverse. Estas ideas tienen 2.300 años de antigüedad.

Demócrito, filósofo y polímata griego, fundador del atomismo y maestro de Protágoras. Créditos: Imagen libre commons.wikimedia.org
Algo más tarde, Epicuro (341-270 a.C aproximadamente) llegó a conclusiones sorprendentemente aproximadas acerca de los átomos. Según él, "entre los átomos, algunas están separados por grandes distancias, otros se acercan muchísimo entre sí para la formación de cuerpos compuestos o se hallan rodeados por otros con los que están combinados. Sin embargo, conservan su peculiar movimiento propio gracias a la naturaleza del vacío, le separa sin oponerles ninguna resistencia. La estabilidad que posee les permite chocar unos con otros sin alterarse esencialmente. Su movimiento de arriba a abajo, su movimiento horizontal hacia adelante y hacia atrás, en virtud de la percusión recíproca de los átomos, tiene como consecuencia una uniformidad global. Además, un átomo no se mueve siempre en la misma dirección, sino que sigue una serie de trayectoria variable".

Epicuro, filósofo griego, destaca por su doctrina sobre el hedonismo racional y el atomismo. Créditos: Imagen libre commons.wikimedia.org
Lo extraordinario y sorprendente es que este conocimiento de los sabios de la antigua Grecia era puramente especulativo, puesto que eran escasamente experimentadores. Además, el estado de la ciencia y de la técnica tampoco les hubiera permitido a aquellos tiempos indagar en la estructura de la materia.
Solo en el siglo XVII, con el conocimiento de los métodos de la química moderna, el hombre reprenderá firmemente el camino, largamente olvidado, que permitirá desvelar de manera incuestionable algunos secretos de la estructura y propiedades de la materia en su estado más elemental. A principio del siglo XIX, Dalton formuló su teoría atómica afirmando la existencia de una serie de elementos simples cuyos átomos se combinaban para formar la sustancia compuesta según proporciones sencillas.

John Dalton, Matemático, químico y meteorólogo Británico, destaca por su trabajo en modelo atómico. Créditos: Imagen libre picryl.com
John Dalton, propuso que todos los átomos de un mismo elemento son iguales en masa, el cual tiene como nombre ley de Dalton del átomo. Por otra parte, propuso que los compuestos químicos resultan de la combinación de átomos de distintos elementos en proporciones simples.
A partir de Dalton, la química avanza prodigiosamente, mientras, por su parte, los físicos realizan constantes descubrimientos que también comprueban por la vía experimental. Todavía se ignora su la complejidad del mundo del átomo, cuándo Roentgen descubre los rayos x en 1895. Este hecho va a tener una importancia decisiva en el desarrollo de la física atómica, especialmente todavía por nacer en aquellas fechas.

Representación del modelo atómico de Dalton. Créditos: commons.wikimedia.org
En 1896, en el transcurso de nuevas investigaciones sobre los rayos X, que ya se sabía eran capaces de impresionar placas fotográficas encerradas en envoltorios opacos a la luz, se descubrió accidentalmente la radiactividad. Henri Becquerel había guardado en un cajón de su laboratorio, en perfecta oscuridad (protegidas contra toda exposición a la luz) unas placas fotográficas y unas muestras de mineral de uranio. Al cabo de unos días, al encontrar este material fotográfico, cuya existencia había olvidado, quiso revelar una placa para comprobar si el material estaba en buen estado, y descubrió entonces con sorpresa que se ve impresionado. La conclusión del científico fue categórica: el mineral de uranio emitía radiaciones parecidas a su comportamiento a los rayos x. Se había descubierto la radiactividad, aunque se desconocía todavía todo sobre ella.

Henri Becquerel, Es considerado como uno de los padres fundadores de la radioquímica y la investigación nuclear moderna. Créditos: Imagen libre picryl.com
Un año después, en 1897, el otro lado del canal de la Mancha, el físico inglés Joseph Thomson, investigando sobre la naturaleza de los rayos catódicos, calculó su velocidad, estimándola muy próxima a los 3.000 km/s. Luego supuso que estos rayos estaban compuestos por corpúsculo y trato de hallar cuál sería la carga eléctrica y la masa de estos corpúsculos, pudiendo establecer que la naturaleza de estos era independiente del gas encerrado en los tubos de descarga y de la materia metálica que componía los filamentos. En su memoria: "no veo forma alguna de escapar a la conclusión de que se trata de cargas de electricidad negativa transportada por partículas de materia". Desde entonces se popularizó el término electrón, nombre dado a esa partícula, cuya existencia demostró experimentalmente Robert Millikan, profesor de la universidad de Chicago, en 1909, encontrado que su masa era de solamente 9,1 x 10^ -28 (0,0000000000000000000000000000091 g) y que su carga eléctrica era también muy pequeña: 1,6 x 10^ -19 culombios.

Joseph Thomson, es considerado uno de los padres fundadores de la física atómica moderna. Su trabajo experimental y teórico sentó las bases para descubrimientos posteriores en este campo. Créditos: Imagen libre commons.wikimedia.org
Alguien pensó entonces que si los átomos tenían electrones, de carga eléctrica negativa, debía existir también en su constitución una parte eléctricamente positiva. Así fue como se instituyó la existencia del protón, demostrada en 1920 de modo categórico. La carga eléctrica del protón es idéntica a la del electrón, pero positiva, y su masa mayor: 1,6 x 10^ -24, g. Entre tanto, el estudio de la radiactividad natural había permitido realizar el sueño dorado de los alquimistas de la edad media. El año 1903, Sir Frederick Soddy y Sir Willian Ramsay habían demostrado que la radiactividad del radio iba acompañada de un desprendimiento de gas helio, y en 1909 rutherford bombardeo átomos de nitrógeno con rayos Alfa, observando que su gas se convertía en oxígeno. Este hecho era importantísimo: por primera vez en la historia de la ciencia alguien había provocado la rotura de un átomo, de manera que con sus elementos constitutivos se había engendrado otro cuerpo simple.

Rutherford, se considera el "padre de la física nuclear" por su descubrimiento de la estructura nuclear del átomo y la fisión controlada. Créditos: Imagen libre commons.wikimedia.org
En el pasado se creía que los átomos tendrían una estructura parecida al sistema solar, ese modelo planetario fue desechado por un nuevo modelo implementado por Rutherford en el que los electrones orbitan alrededor de un núcleo atómico positivo.
En la próxima entrega, daremos continuidad a este interesante tema.
¡Hasta la próxima, Hivernautas!
Créditos:
Imagen 1: Autoría propia. Realizada con base en imágenes libres.
Imagen 2: Fuente
Imagen 3: Fuente
Imagen 4: Fuente
Imagen 5: Fuente
Imagen 6: Fuente
Imagen 7: Fuente
Imagen 8: Fuente
Imagen 9: Fuente
REFERENCIA
- https://www.areaciencias.com/descubrimiento-ciencias/descubrimiento-del-atomo/
- https://www.geoenciclopedia.com/modelo-atomico-de-democrito-245.html
- https://www.filosofia.org/enc/ros/democ.htm
- https://plato.stanford.edu/entries/epicurus/
- https://plato.stanford.edu/entries/epicurus/
- https://museovirtual.csic.es/coleccion/amaniel/radiactividad/radio3.htm
- https://www.bbvaopenmind.com/ciencia/fisica/la-revolucion-del-electron/
- https://historia-biografia.com/joseph-john-thomson/
- https://www.nobelprize.org/prizes/chemistry/1908/rutherford/biographical/

English Edition

Atomic Energy: The Atom part 1
Hello, hello, Hivernauts! On this occasion I will address a very interesting saga and I hope it is to your liking, I am referring to nothing more and nothing less than Atomic Energy, but to get into the subject it is essential to know a very important chemical element, The Atom. Atoms are the smallest subatomic particles of matter. It contains a complex structure that integrates neutrons, protons, and electrons. The protons are found in the nucleus and determine the chemical trait of the atom, while the electrons surround the nucleus. And if we study how the historical process of the discovery of the Atom has been?

Representation of an Atom. Credits: Image free commons.wikimedia.org
Although the discovery and application of atomic energy are things of our time, some sages of antiquity had already glimpsed certain aspects of the constitution of matter.
Around the year 450 BC, Empedocles postulated the principle of conservation of matter, which Lavoisier would verify experimentally 21 centuries later: matter is neither created nor destroyed, but it can turn. Zeno and Democritus came to proclaim the existence of atoms as the smallest particles into which matter could be divided. This fundamental unit of matter was, for them, an incredibly small corpuscle, endowed with movement and requiring a certain amount of space to move. These ideas are 2,300 years old.

Democritus, Greek philosopher and polymath, founder of atomism and teacher of Protagoras. Credits: Image free commons.wikimedia.org
Somewhat later, Epicurus (c. 341-270 B.C.) came to surprisingly approximate conclusions about atoms. According to him, "among the atoms, some are separated by great distances, others are very close to each other for the formation of composite bodies or are surrounded by others with which they are combined. However, they retain their own peculiar motion thanks to the nature of the vacuum, separates it without offering any resistance. The stability it possesses allows them to collide with each other without essentially altering. Their movement from top to bottom, their horizontal movement forwards and backwards, by virtue of the reciprocal percussion of the atoms , results in a global uniformity. Furthermore, an atom does not always move in the same direction, but follows a series of variable trajectories".

Epicurus, a Greek philosopher, stands out for his doctrine on rational hedonism and atomism. Credits: Image free commons.wikimedia.org
What is extraordinary and surprising is that this knowledge of the sages of ancient Greece was purely speculative, since they were hardly experimenters. In addition, the state of science and technology would not have allowed those times to investigate the structure of matter either.
Only in the 17th century, with the knowledge of the methods of modern chemistry, man will firmly rebuke the long-forgotten path, which will unquestionably reveal some secrets of the structure and properties of matter in its most elementary state. At the beginning of the 19th century, ** Dalton ** formulated his atomic theory, affirming the existence of a series of simple elements whose atoms combined to form the compound substance according to simple proportions.

John Dalton, British mathematician, chemist and meteorologist, noted for his work on the atomic model. Credits: Free image picryl.com
John Dalton, proposed that all atoms of the same element are equal in mass, which is called Dalton's law of the atom. On the other hand, he proposed that chemical compounds result from the combination of atoms of different elements in simple proportions.
From Dalton, chemistry advances prodigiously, while, for their part, physicists make constant discoveries that they also verify experimentally. The complexity of the world of the atom is still unknown, when Roentgen discovers x-rays in 1895. This fact will have a decisive importance in the development of atomic physics, especially still to be born at that time.

Representation of Dalton's atomic model. Credits: commons.wikimedia.org
In 1896, in the course of further research on X-rays, which were already known to be capable of impressing photographic plates enclosed in light-opaque wrappers, radioactivity was accidentally discovered. ** Henri Becquerel ** had kept in a drawer in his laboratory, in perfect darkness (protected against all exposure to light) some photographic plates and some samples of uranium ore. After a few days, upon finding this photographic material, the existence of which he had forgotten, he wanted to reveal a plate to check if the material was in good condition, and then discovered to his surprise that he looks impressed. The scientist's conclusion was categorical: the uranium ore emitted radiation similar to its behavior in x-rays. Radioactivity had been discovered, although everything about it was still unknown.

Henri Becquerel, He is considered one of the founding fathers of modern radiochemistry and nuclear research. Credits: Free image picryl.com
A year later, in 1897, on the other side of the English Channel, the English physicist Joseph Thomson, investigating the nature of cathode rays, calculated their speed, estimating it very close to 3,000 km/s. Then he assumed that these rays were made up of corpuscles and tried to find out what the electrical charge and mass of these corpuscles would be, being able to establish that their nature was independent of the gas enclosed in the discharge tubes and the metallic matter that made up the corpuscles. filaments. In his memory: "I see no way to escape the conclusion that these are charges of negative electricity carried by particles of matter." Since then the term electron has become popular, the name given to that particle, whose existence was experimentally demonstrated by Robert Millikan, a professor at the University of Chicago, in 1909, finding that its mass was only 9.1 x 10^ -28 (0.0000000000000000000000000000091 g) and that its electric charge was also very small: 1.6 x 10^ -19 coulombs.

Joseph Thomson is considered one of the founding fathers of modern atomic physics. His experimental and theoretical work laid the foundation for later discoveries in this field. Credits: Image free commons.wikimedia.org
Someone then thought that if atoms had electrons, with a negative electrical charge, there must also be an electrically positive part in their constitution. This is how the existence of the proton was established, demonstrated categorically in 1920. The electric charge of the proton is identical to that of the electron, but positive, and its mass is greater: 1.6 x 10^ -24, g. Meanwhile, the study of natural radioactivity had made it possible to realize the golden dream of the alchemists of the Middle Ages. In 1903 Sir Frederick Soddy and Sir Willian Ramsay had shown that radium radioactivity was accompanied by an evolution of helium gas, and in 1909 rutherford bombarded nitrogen atoms with alpha rays , observing that its gas was converted to oxygen. This fact was extremely important: for the first time in the history of science someone had caused an atom to break, so that with its constituent elements another simple body had been engendered.

Rutherford, is considered the "father of nuclear physics" for his discovery of the nuclear structure of the atom and controlled fission. Credits: Image free commons.wikimedia.org
In the past it was believed that atoms would have a structure similar to the solar system, that planetary model was discarded by a new model implemented by Rutherford in which electrons orbit around a positive atomic nucleus.
In the next installment, we will continue this interesting topic.
Until next time, Hivernauts!
credits:
Imagen 1: Autoría propia. Realizada con base en imágenes libres.
Imagen 2: Fuente
Imagen 3: Fuente
Imagen 4: Fuente
Imagen 5: Fuente
Imagen 6: Fuente
Imagen 7: Fuente
Imagen 8: Fuente
Imagen 9: Fuente
REFERENCE
- https://www.areaciencias.com/descubrimiento-ciencias/descubrimiento-del-atomo/
- https://www.geoenciclopedia.com/modelo-atomico-de-democrito-245.html
- https://www.filosofia.org/enc/ros/democ.htm
- https://plato.stanford.edu/entries/epicurus/
- https://plato.stanford.edu/entries/epicurus/
- https://museovirtual.csic.es/coleccion/amaniel/radiactividad/radio3.htm
- https://www.bbvaopenmind.com/ciencia/fisica/la-revolucion-del-electron/
- https://historia-biografia.com/joseph-john-thomson/
- https://www.nobelprize.org/prizes/chemistry/1908/rutherford/biographical/
